 |
||||||
Durch das freie Elektronenpaar am N-Atom reagieren Amine basisch:
Allgemein:
R-NH2 + H-B ergibt R-NH3+ + B-
In der Reihe
Amine - Alkohole - Carbonsäuren
abnehmende Basizität und zunehmende Acidität.
Einflüsse auf die Basizität von Aminen
Erhöhung der Basizität durch:
+ I-Effekt:
Erhöhung der Elektronendichte am N-Atom führt zu erleichtertem Protoneneinfang
Hydratisierung (H-Brücken-Bildung) des entstandenen Alkylammonium-Ions:
H-Brücken stabilisieren das Ion (Erschwerung der Rückreaktion) 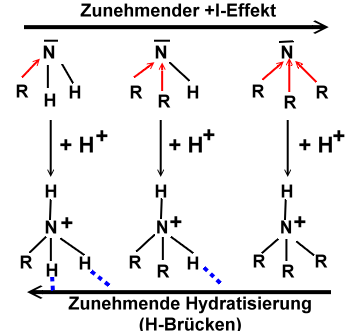
Erniedrigung der Basizität durch:
- I-Effekt:
(z. B. durch OH-Gruppen in den Resten R) vermindern die Elektronendichte
Sterische Behinderung der Hydratisierung:
durch sperrige Reste R, z. B. bei tert-Butylamin.
Mesomere Effekte bei aromatischen Aminen (Aminogruppe direkt am aromatischen System):
Die Aminogruppe übt einen +M-Effekt aus, d. h. das freie Elektronenpaar
nimmt an der Delokalisation der Elektronen des aromatischen Systems teil. Dies führt zur
Verringerung der Elektronendichte am N-Atom.Beispiel Anilin: 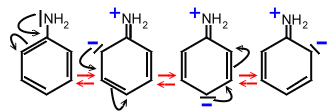
![]()
(Falls - bei "Seiteneinsteigern", die nicht über die Homepage gekommen sind - der Navigationsbalken mit dem Inhaltsverzeichnis nicht zu sehen ist: