Eine kurze Einführung in die (Spektral-) Photometrie
|
Die Photometrie ist eine vielfach angewandte, vergleichsweise kostengünstige, schnelle und einfache Analysenmethode in modernen Laboratorien. Diese Methode ist relativ empfindlich: Mit ihr können noch wenige Milligramm des zu untersuchenden Stoffes quantitativ bestimmt werden. Die Photometrie beruht auf der Tatsache, daß ein Teil des durchtretenden Lichts (UV-VIS = UV und sichtbarer Bereich ca. 200 - 900 nm Wellenlänge) durch die flüssige Probe geschwächt wird. Dabei wird die Eigenfärbung der Probe oder die Färbung der Probe durch Zugabe geeigneter Nachweisreagenzien ausgenutzt: |

|
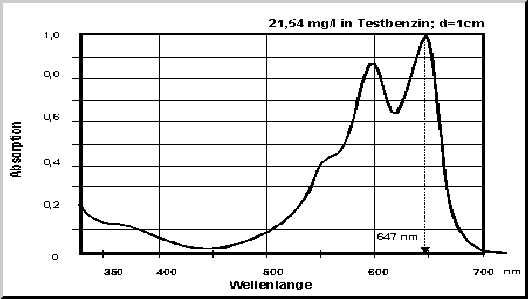
Jeder Farbstoff besitzt ein individuelles Farbspektrum. Die geeignete Wellenlänge für die Bestimmung muß vorher bekannt sein, oder aus dem Spektrum bestimmt werden. In dem angeführten Beispiel eines Farbstoffes der Firma BASF wird bei 647 nm analysiert. |
|
Der prinzipielle Aufbau eines Photometers:
Von einer Lichtquelle L werden, nach dem ein dünner Strahl durch die Optik O mit Spaltblende S ausgesondert wurde, bestimmte Wellenlängen durch Filter oder Prismen (Monochromator) M selektiert. Für z.B. orangefarbene Lösungen wird ein Filter der Komplimentärfarbe blau verwendet. Diese monochromatische (einfarbige) Strahlung gelangt zur Küvette K, einem quaderförmigen Glasgefäß für die zu bestimmende Lösung (ca. 1-5 ml Inhalt, genau angegebenen Innenabmessungen, meist 1.0 cm "Schichtdicke"), in der das durch die Lösung gehende Licht je nach Konzentration des Farbstoffes geschwächt wird. Das Licht gelangt schließlich zum Strahlungsempfänger E (Photozelle, Licht à Elektrizität) und zur Intensitätsanzeige A (Elektronik/ Computer/ Schreiber/ Drucker). |
|
Die Absorption (Schwächung des Lichtes) A ist abhängig von:
Ausgewertet wird nach dem Lambert-Beersches Gesetz A = e (l ) * d * c , das streng genommen nur für kleine Konzentrationen (unter ungefähr 0.1 mol/l Farbstoff) gilt. |
|
Prinzipielles Beispiel Eine wäßrige Probe, z.B. Abwasser, soll auf einen bestimmten Stoff, z.B. Phosphat, untersucht werden. Es werden in drei 50,0 ml Meßkolben je 10,0 ml der Standardlösungen, das sind Lösungen mit genau bekanntem Gehalt des zu bestimmenden Stoffes, gefüllt (pipettiert): 0,00 mg/l PO43- (Blindwert s.u.), 1,00 mg/l PO43- (Standard 1), 5,00 mg/l PO43- (Standard 2). In den vierten kommt 10,0 ml der zu untersuchenden Probelösung. Anschließend werden die Nachweisreagenzlösungen zugesetzt. In diesem Beispiel sind es 10.0 ml einer Schwefelsäure-Ammoniummolybdat-Ascorbinsäure Lösung, die mit Phosphat einen tief blauen Farbstoff bildet. Es wird mit destilliertem Wasser auf genau 50.0 ml aufgefüllt, geschüttelt, und eine bestimmte Zeit gewartet bis sich der Farbstoff vollständig gebildet hat. Die vier Lösungen werden bei einer bestimmten Wellenlänge gemessen. Es ist zu beachten, das der Gehalt des zu untersuchenden Stoffes in der Probenlösung zwischen dem ersten und dem letzten Standard befinden muß, da nur dieser Bereich durch die Kalibriergerade (s.u.) definitiv bestimmt ist. In der Praxis ist eine Kalibrierung mit bis zu zehn Standards üblich. Allerdings können andere Stoffe den Nachweis stören, z.B. indem sie einen ähnlichen Farbstoff bilden, so daß es zu falschen Analysenwerten kommen kann. Genaue Anweisungen wie man vorzugehen hat, welche Stoffe die Nachweise stören und wie diese Störungen beseitigt werden können, sind reichlich und gut dokumentiert vorhanden.
|
Auswertung
|
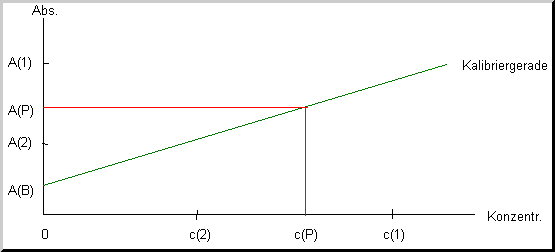
Der Graph der Kalibrierfunktion mit sog. Kalibrierstandards, das sind Lösungen mit bekannten Konzentrationen, c(1) und c(2), ergibt im Diagramm mit den zugehörigen Absorptionswerten im Idealfall eine Gerade. Im Diagramm ist deutlich zu sehen, daß die Kalibriergerade nicht durch den Nullpunkt des Koordinatensystems geht. Das ist leicht dadurch zu erklären, daß die Küvette bzw. das Lösemittel auch ohne den zu bestimmenden Stoff eine Eigenabsorption hat. Diesen Wert nennt man Blindwert (hier A(B)). Der gemessenen Absorption einer unbekannten Probe A(P) kann leicht durch die rote Linie eine Konzentration c(P) zugewiesen werden. Bei allen modernen Geräten wird die Auswertung per Elektronik oder Computer vorgenommen.
|

Ansicht eines Laborphotometers (Perkin-Elmer)
|
Mit Hilfe solcher Instrumente können am Tag Dutzende von Proben analysiert werden. Der auftretende Fehler liegt, optimale Probenvorbereitung und geeignete Analysenmethode vorausgesetzt, unter einem Prozent.
Literatur: Georg Schwendt; Taschenatlas der Analytik, Georg Thieme Verlag, Stuttgart-New York, 1992 WTW; Fibel zur photometrischen Wasser- und Abwasser-Analytik, Firmenschrift der Firma WTW Weilheim (Oberbayern) |
 Fehlerbetrachtung Fehlerbetrachtung |
 Home Home |
 Start Start |